por Fabián Retamar
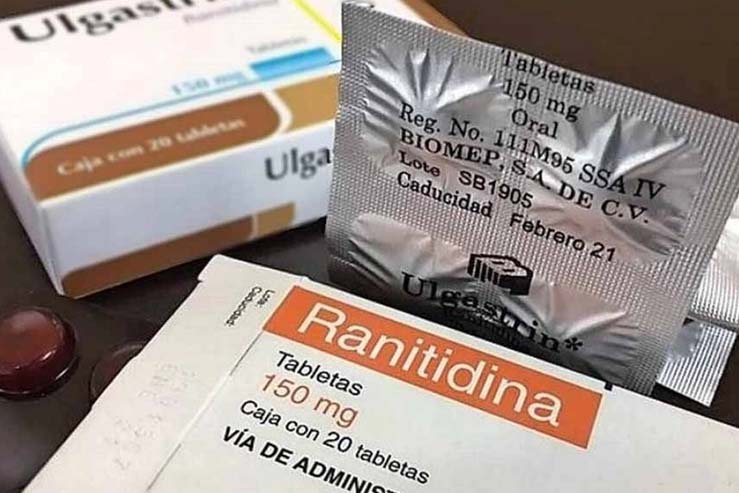
La ranitidina es un medicamento de venta libre utilizado comúnmente como antiácido, que tiene más de 40 años en el mercado y es utilizado en casi todo el mundo. En octubre de 2019 la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) detectó e informó que los niveles de un químico presente en su constitución podría causar cáncer, y esto hizo que varios países comenzaran a suspender su comercialización.
Según se informó oportunamente, el problema habría comenzado cuando ciertas empresas farmacéuticas productoras de la ranitidina empezaron a comprar materia prima en algunos países de Asía, donde existen fábricas que no cumplen con todos los controles de calidad internacionales.
En aquella oportunidad, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) suspendió la elaboración de medicamentos que contuvieran ranitidina, aunque sugirió no interrumpir los tratamientos en curso y consultar con el profesional médico sobre alternativas terapéuticas.
No obstante, tras aquella noticia, y dadas las constantes investigaciones, unos meses después, en febrero de 2020, la Ranitidina volvió a comercializarse. Sin embargo ahora, una nueva investigación asegura que la Ranitidina contiene N-nitrosodimetilamina (NDMA), una molécula que fue prohibida por la Unión Europea y por la FDA estadounidense por posibles consecuencias cancerígenas.
Esto no significa que la Ranitidina provoque una enfermedad, sino que están estudiando las consecuencias de su consumo en determinadas dosis. En tal sentido en nuestro país, con fecha 22 de diciembre de 2020, la ANMAT suspendió preventivamente la venta del medicamento en todo el territorio nacional de todas las especialidades medicinales que contengan RANITIDINA como Ingrediente Farmacéutico Activo (IFA), como monodroga o en asociación con otros IFA, en sus formas farmacéuticas orales, en todas sus concentraciones y presentaciones, por los fundamentos expuestos en el considerando de la presente disposición.
El artículo segundo de la disposición ordena a los laboratorios titulares de certificados de especialidades medicinales que contengan RANITIDINA como Ingrediente Farmacéutico Activo (IFA), como monodroga o en asociación con otros IFA, en formas farmacéuticas orales, deberán proceder al retiro del mercado de todas las unidades alcanzadas por la presente medida, en un plazo de 30 días corridos a partir de la entrada en vigencia de la presente disposición, debiendo presentar ante el Instituto Nacional de Medicamentos la documentación respaldatoria correspondiente.
De acuerdo a un relevamiento realizado hace algún tiempo por Pharmabiz, en el mercado local hay alrededor de 20 marcas a base de ranitidina como monodroga.